Lösungen zu den Chemieaufgaben für Biologen
Beispielaufgaben aus dem Chemiekurs für Biolog:innen – Lösungen
Aufgabe 1:
a.)
![]()
b.)
|
Elementsymbol |
Kernladung |
Massenzahl |
Protonen |
Neutronen |
Elektronen |
|
S2‒ |
16 |
32 |
16 |
16 |
18 |
Aufgabe 2:
M(OsO4) = 254,23 g/mol; n(OsO4) = 0,0889 mol = 88,9 mmol; Teilchenzahl N(Os) = 5,35 * 1022;
Teilchenzahl N(O) = 2,14 * 1023
Aufgabe 3:
![]()
Fe3O4 (Magnetit)
Aufgabe 4:
a.) 31Ga
b.) 82Pb
Aufgabe 5:
a.) 20 Elektronen (alle d-Orbtale)
b.) 22 Elektronen (5 x 2 in s, 4 x 2 in p, 2 x 2 in d)
Antwort 6:
Wasser ist mit einem Unterschied der Elektronegativitäten von Wasserstoff und Sauerstoff von 1,3 als polare kovalente Bindung einzustufen, während die höheren Dihydrogenchalkogenide mit Differenzen von 0,1 bis 0,2 keine polarisierten Bindungen aufweisen. In Wasser sind daher zum Einen elektrosta-tische Wechselwirkungen zwischen den permanenten Dipolen und zum Anderen die Ausbildung von Wasserstoffbrücken stark ausgeprägt. Dies führt zu einer deutlichen Erhöhung der Siedetemperatur gegen über den schwereren Homologen, da die intermolekularen Kräfte zwischen den Wassermolekülen die Phase stärker zusammen halten und für den Phasenübergang flüssig-gasförmig mehr Energie zur Überwindung dieser attraktiven Wechselwirkungen benötigt wird.
Aufgabe 7:
a.) CaSO3 Calciumsulfit → Ca2+ + SO32‒
b.) Fe(NO3)2 Eisen(II)-nitrat → Fe2+ + 2 NO3‒
c.) Kobalt(II)-sulfid CoS → Co2+ + S2‒
d.) Schwefeltetrachlorid SCl4 → keine Dissoziation; Nichtmetallhalogenid
Aufgabe 8:
a.)

b.)
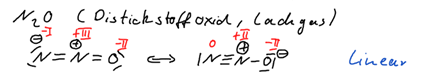
Aufgabe 9:
a.) NaCl + AgNO3 → NaNO3 + AgCl ↓
b.) 1 Al4C3 + 12 H2O → 4 Al(OH)3 + 3 CH4
Aufgabe 10:
c(HNO3) = 14,35 mol/L
Aufgabe 11:
c(Essigsäure) = 5,62 * 10-4 mol/L; m(Essigsäure) = 1,69 g; V(Eisessig) = 1,61 mL
Aufgabe 12:
a.) pH = 4,93
b.) pH = 4,75
Aufgabe 13:
a.) NO3– + 3 Cl– + 4 H3O+ ⇌ NOCl + Cl2 + 6 H2O NOCl → NO+ + Cl– Ox: Cl(-I → 0) Red: N(+V → +III)
b.) MnO4– + 4 Mn2+ + 15 C2O42- + 8 H3O+ ⇌ 5 [Mn(C2O4)3]3- + 12 H2O (Komproportionierung +VII & +II → +III)
Aufgabe 14:
Ag2CrO4 → 2 Ag+ + CrO42-
![]()
c(Ag+) = 1,56 * 10-4 mol/L; m(Ag2CrO4) = 259 mg
Aufgabe 15:
a.) Tetrachloridocuprat(II);
KZ = 4; Oxidationsstufe Cu = +II; Bei KZ = 4 sind quadratisch-planar sowie tetraedrisch als Koordi-nationsgeometrien denkbar.
b.) [Cu(H2O)6]2+ + 4 HCl → [CuCl4]2- + 2 H2O + 4 H3O+
![]()
Aufgabe 16:

Aufgabe 17:
Aspartam (2 Stereozentren → 4 mögliche Stereoisomere)
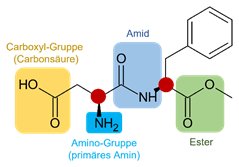
Aufgabe 18:
alle zyklischen Isomere von 2-Penten => C5H10

Aufgabe 19:
a.) Benennen


![]()
b.) Zeichnen

![]()

Aufgabe 20:

Aufgabe 21:
Es handelt sich um Anomere. Die beiden Moleküle sind Kohlenhydrate, genauer Monosaccharide aus der Gruppe der Aldohexosen. Links dargestellt ist a-D-Glucose und rechts b-D-Glucose.

Aufgabe 22:
neo-Pentylcyclohexan

Aufgabe 23:
Nach steigender Säurestärke, d.h. nach fallendem pKS. Ein -I-Effekt durch die Halogensubstituenten lässt die Säurestärke von Iod nach Fluor ansteigen.

Aufgabe 24:

Aufgabe 25:
aufsteigende Stabilität Carbeniumion

Aufgabe 26:

Aufgabe 27:

